利用化学重编程多能干细胞治疗糖尿病,丁列明/邓宏魁领衔的瑞普晨创完成超亿元A轮融资
来源:生物世界 2024-11-06 15:32
丁列明/邓宏魁团队将化学重编程多能干细胞分化而来的胰岛移植到了一名1型糖尿病(T1D)患者的腹直肌前鞘下,获得了可耐受的安全性,并且在1年随访中不再需要外源胰岛素治疗,且恢复了血糖控制。
多能干细胞(Pluripotent stem cell,PSC)因其具有自我更新和分化成功能细胞类型的能力,因此作为无限的细胞来源,在诸如胰岛移植等细胞替代疗法中显示出巨大潜力。
2024年11月1日,杭州瑞普晨创科技有限公司(简称“瑞普晨创”)宣布完成超亿元A轮融资。本轮融资由中国风投领投,贝达药业、联想创投、荷塘创投、贝橙创投等跟投。

瑞普晨创由丁列明博士和邓宏魁教授领衔,致力于拓展细胞疗法在多种重大、疑难疾病领域的应用。该公司已经率先将化学重编程诱导多能干细胞(CiPSC)应用到临床级别制备体系,进一步开展CiPSC分化的胰岛细胞治疗1型糖尿病的临床研究。
目前,瑞普晨创基于创新的人多能干细胞技术的细胞治疗药物已在治疗糖尿病方向规划多条管线,其自主研发的RGB5088胰岛细胞注射液的临床试验申请(IND)已获得中国NMPA受理,这也是我国首个获IND受理的用于治疗1型糖尿病的多能干细胞产品。
RGB5088胰岛细胞注射液已于2023年7月在天津市第一中心医院入组了第一位受试者,该受试者是一位病史十多年的1型糖尿病患者。该患者在治疗后不到3个月的时间内就摆脱了胰岛素依赖,在1年随访中不再需要外源胰岛素治疗,且恢复了血糖控制。
2022年,北京大学邓宏魁教授首次实现了完全利用化学小分子诱导人类体细胞转变为多能干细胞——化学诱导多能干细胞(CiPSC)。传统的iPSC是通过在体细胞中过表达转录因子而产生的,而CiPSC的产生则采用了非生物的、小分子化学物质作为重编程因子,具有易于制造和标准化,不整合到基因组中,可扩展且可微调等优势。
CiPSC技术开辟了人多能干细胞(hPSC)制备的全新途径,这是我国自主研发的新一代人多能干细胞制备技术,也为我国干细胞和再生医学的发展解决了底层技术上的“瓶颈”问题。
2024年9月25日,邓宏魁团队与南开大学/天津市第一中心医院沈中阳、王树森团队、杭州瑞普晨创科技有限公司的研究人员合作,在国际顶尖学术期刊 Cell 上发表了题为Transplantation of chemically induced pluripotent stem-cell-derived islet under the abdominal anterior rectus sheath in a type 1 diabetes patient 的研究论文。
研究团队将化学重编程多能干细胞分化而来的胰岛(CiPSC-islets)移植到了一名1型糖尿病(T1D)患者的腹直肌前鞘下,获得了可耐受的安全性,并且在1年随访中不再需要外源胰岛素治疗,且恢复了血糖控制。
这名患者的治疗效果鼓舞人心,支持了腹直肌前鞘下CiPSC-胰岛移植治疗1型糖尿病(T1D)的可行性。

除了产生人多能干细胞(hPSC)外,诱导PSC分化为具有功能的胰岛样细胞(hPSC-islets)是包括邓宏魁团队在内的干细胞领域学者几十年来的追求。
最初的分化方案专注于从胚胎干细胞(ESC)和诱导多能干细胞(iPSC)中在体外获得产生胰岛素的β样细胞。之后的研究专注于更有效地获得具有改善的胰岛素分泌功能的β样细胞,从而产生了功能性的hPSC来源的β细胞。
邓宏魁团队建立了一种高效、优化的分化方案,用于生成CiPSC来源的胰岛样细胞(CiPSC-islets),其转录组特征、组成和胰岛素分泌功能与天然人类胰岛相当。他们还在非人灵长类动物中进行临床前研究,以评估CiPSC-胰岛的安全性和有效性,结果显示,在长期观察期间,CiPSC-胰岛改善了糖尿病,没有发生肿瘤,展示了显著的治疗潜力。
重要的是,在这些体外研究中,邓宏魁团队还开发出了适用于hPSC-胰岛的合适的移植策略。由于传统的胰岛通过肝门静脉注射移植存在一定的局限性,例如由于即刻血源性炎症反应(IBMIR)引起的急性移植物丢失,因此寻找更适合移植物生存的替代移植位点已成为近年来的研究热点。邓宏魁团队发现,将hPSC-胰岛移植到肝外位点(腹直肌前鞘下方)可获得更好的胰岛存活和成熟效果,C肽(内源性胰岛素分泌的标志物)的分泌水平和刺激指数接近非糖尿病患者的水平。这种独立的腹膜外移植位点还具有包括注射部位微创和易于成像在内的重要优点。总的来说,这些研究为hPSC-胰岛在人类患者中的临床转化奠定了基础。
在这项最新研究中,研究团队进行了一项探索性临床试验,首次使用患者自体CiPSC来源的胰岛移植用于治疗免疫抑制的1型糖尿病(T1D)患者,结果显示,该患者不再需要使用胰岛素治疗且恢复了实现了持续的血糖控制的恢复。
该论文报道了正在进行中的TJFCH-iPS-001临床试验纳入的第一例患者的治疗结果,该临床试验旨在评估自体患者CiPSC-胰岛作为1型糖尿病(T1D)治疗策略的安全性、耐受性和治疗效果。患者特异性CiPSC是通过邓宏魁团队之前报道的化学重编程方法产生,随后使用之前建立的实验方案在体外分化为分泌胰岛素的胰岛样细胞,并在整个制造过程中进行了质量控制评估,然后将得到的CiPSC-胰岛在超声引导下注射移植到患者腹直肌前鞘。
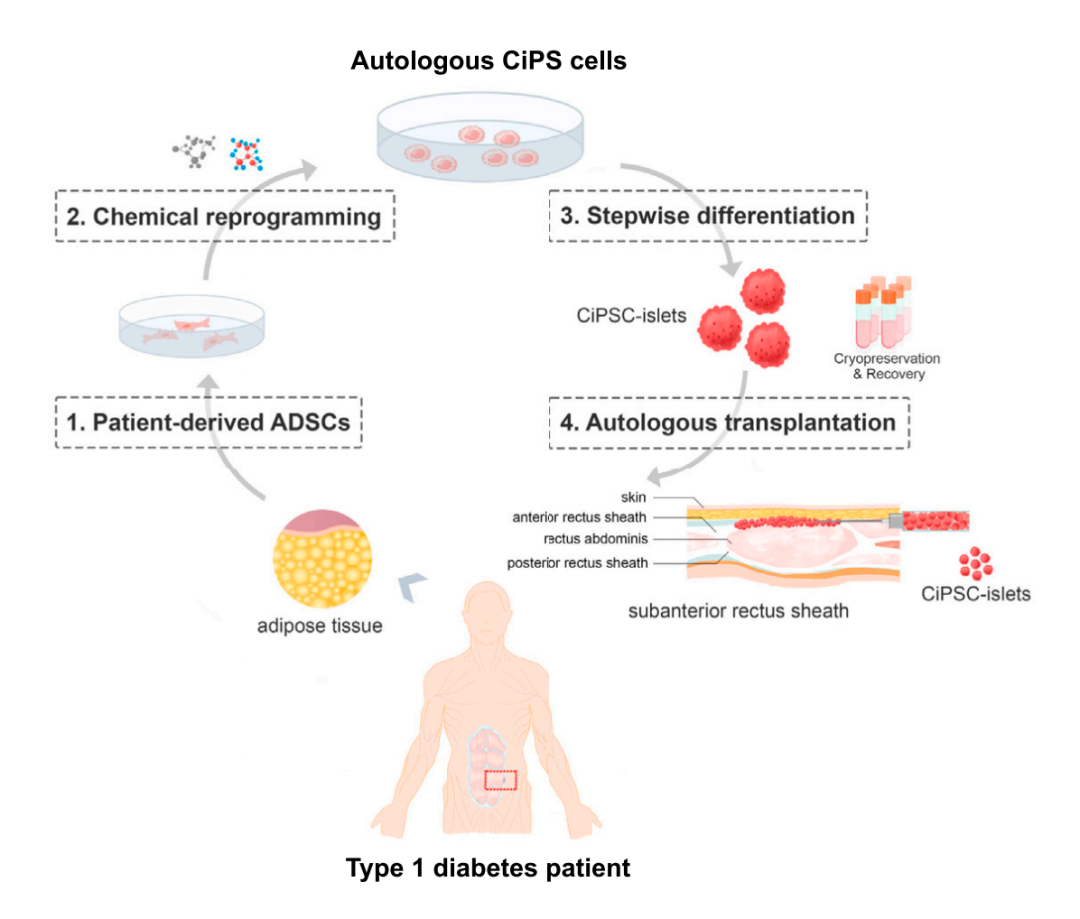
这名25岁的女性在2012年被诊断患有1型糖尿病(T1D),她曾因隐源性肝硬化分别在2014年和2016年进行了肝移植,在2017年因血糖控制不稳定进行了1次全胰腺移植,但一年后因为严重血栓性并发症,胰腺移植物被切除。此外,为了维持肝移植,她需要定期接受免疫抑制治疗。2023年6月,她接受了CiPSC-胰岛移植。
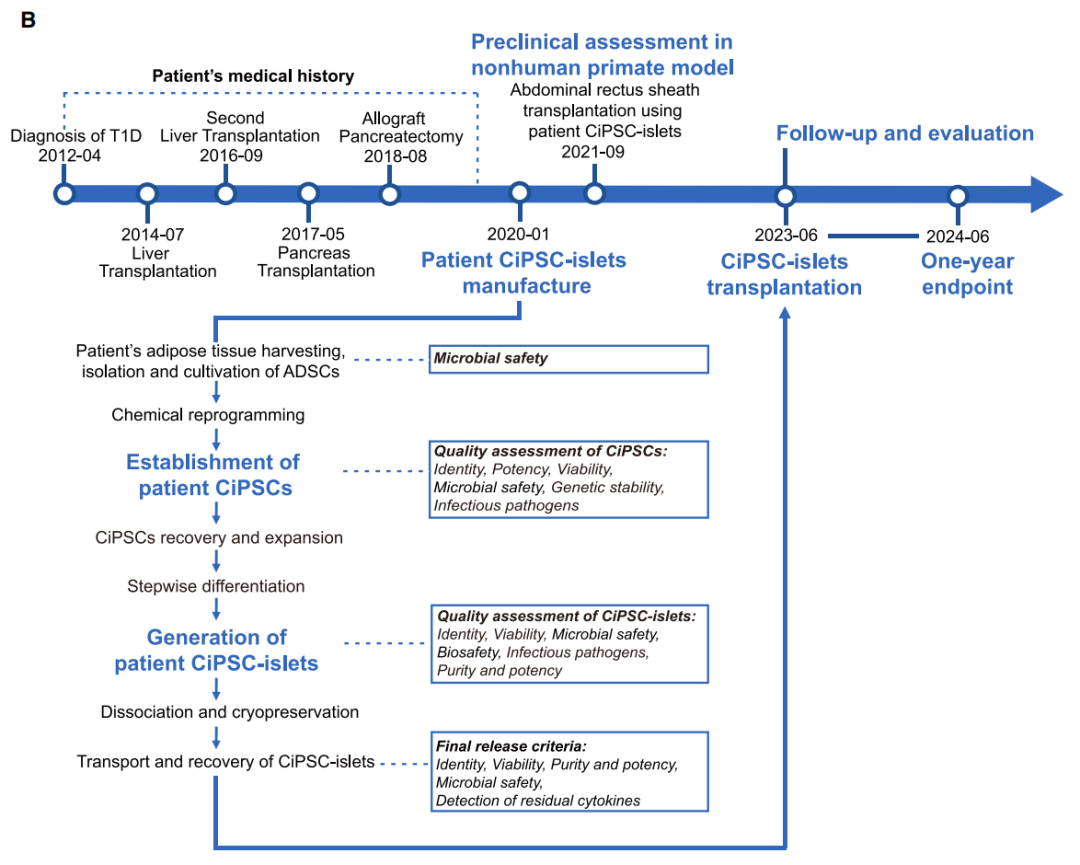
研究团队对该患者进行了1年时间的跟踪随访,患者在移植后第75天开始不再需要胰岛素治疗,在移植后第4个月时,目标血糖范围的达标时间从基线值的43.18%提高到了96.21%,同时,糖化血红蛋白(HbA1c)指标也出现了下降,达到了非糖尿病患者的长期系统性血糖水平。从那以后,患者的血糖控制状态稳定,血糖达标时间超过98%,糖化血红蛋白水平约为5%。在这一年的临床数据中,所有研究终点均已达到,没有出现与移植相关的异常情况的迹象。
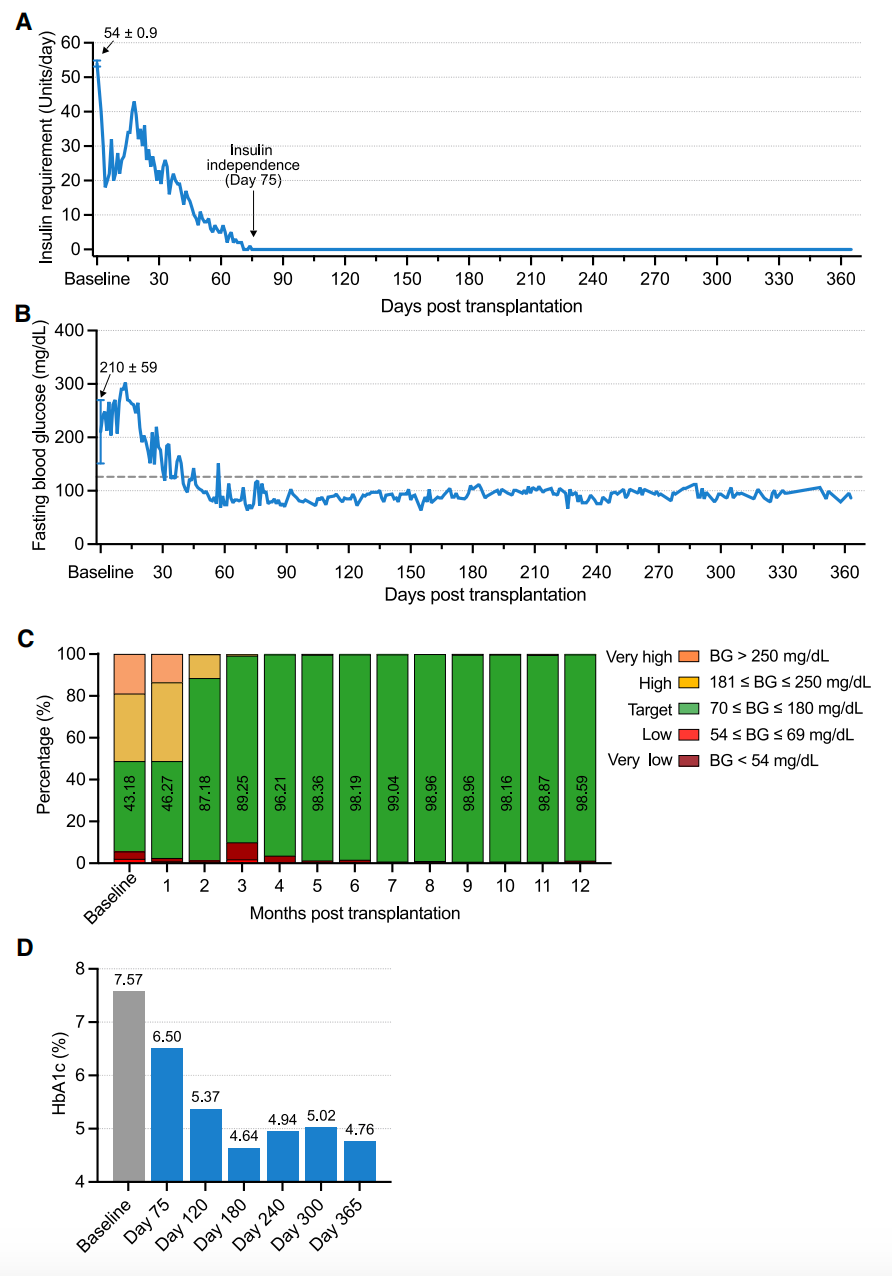
总的来说,该研究报告了在一例1型糖尿病(T1D)患者中进行的CiPSC-胰岛自体移植。在移植前,该患者长期患有难以控制的糖尿病,并伴有严重的低血糖发作。移植后,该患者在不到3个月的时间内就摆脱了胰岛素依赖,最终在不使用外源性胰岛素的情况下,血糖达标时间达到98%以上。
这名患者的治疗效果鼓舞人心,支持了腹直肌前鞘下CiPSC-胰岛移植的可行性,有必要进行进一步的临床研究,以评估CiPSC-胰岛移植在1型糖尿病(T1D)中的应用。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


